動画視聴
TC0083_岡野の化学(83)
TC0084_岡野の化学(84)
TC0085_岡野の化学(85)
0368_Varian-GC/MS特許を読む(34)
0369_Varian-GC/MS特許を読む(35)
0372_Varian-GC/MS特許を読む(36)
0373_Varian-GC/MS特許を読む(37)
1010_Wシリーズについて
ノートまとめ
同位体、同素体
原子量、質量の違い
周期表:アルカリ金属、アルカリ土類金属、希ガス、ハロゲン
同位体と同素体の違い
同位体:同じ元素だけど、中性子の数が異なる=質量が異なる。
例)酸素同位体:16O、17O、18O。16Oの天然存在比は99.7%
炭素同位体:12C、13C、14C。12Cの天然存在比は98.93%
基本的には、原子番号(陽子の数)+中性子の数の質量がその元素の存在比を多く占める。が、少数、中性子の異なる元素が存在する。
同素体:同一元素の原子同士が結合して異なる物質を作る
例)炭素
同じCでも結合の種類によって違う物質になる。
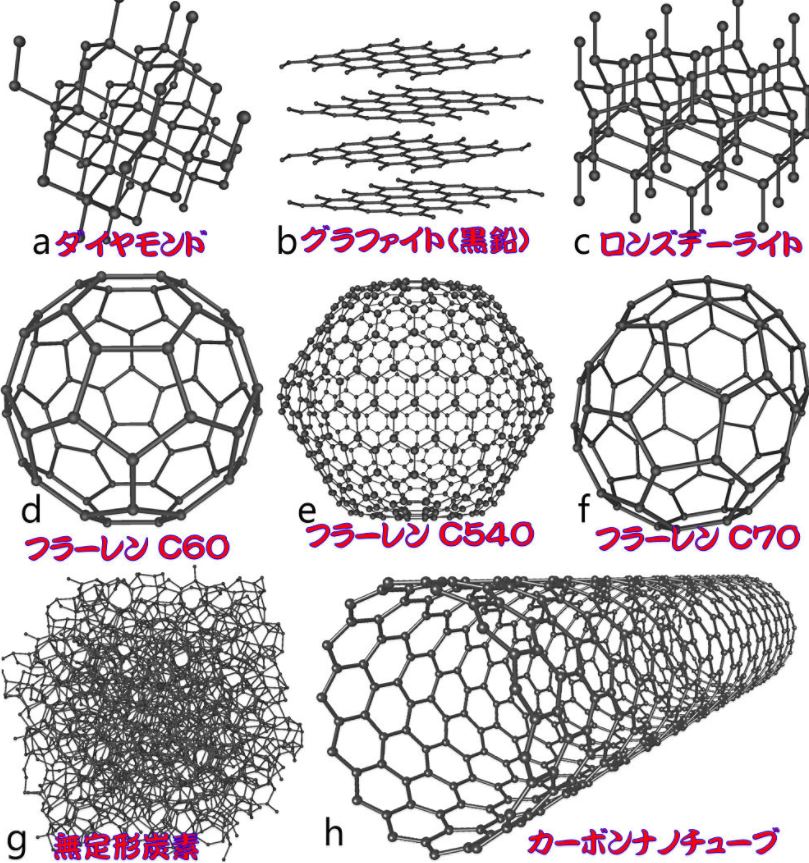
参考 http://tatsuo.gnk.cc/HypLink/kobutsu/85_kobutsu_etc/85J_syukiritsu/syukiritsuhyo.htm
その他、水素、リン酸、硫黄にも同素体がある。
原子量と質量数の違い
原子量と、質量数の違いを理解するのにとまどったので、ノートにまとめてみました。
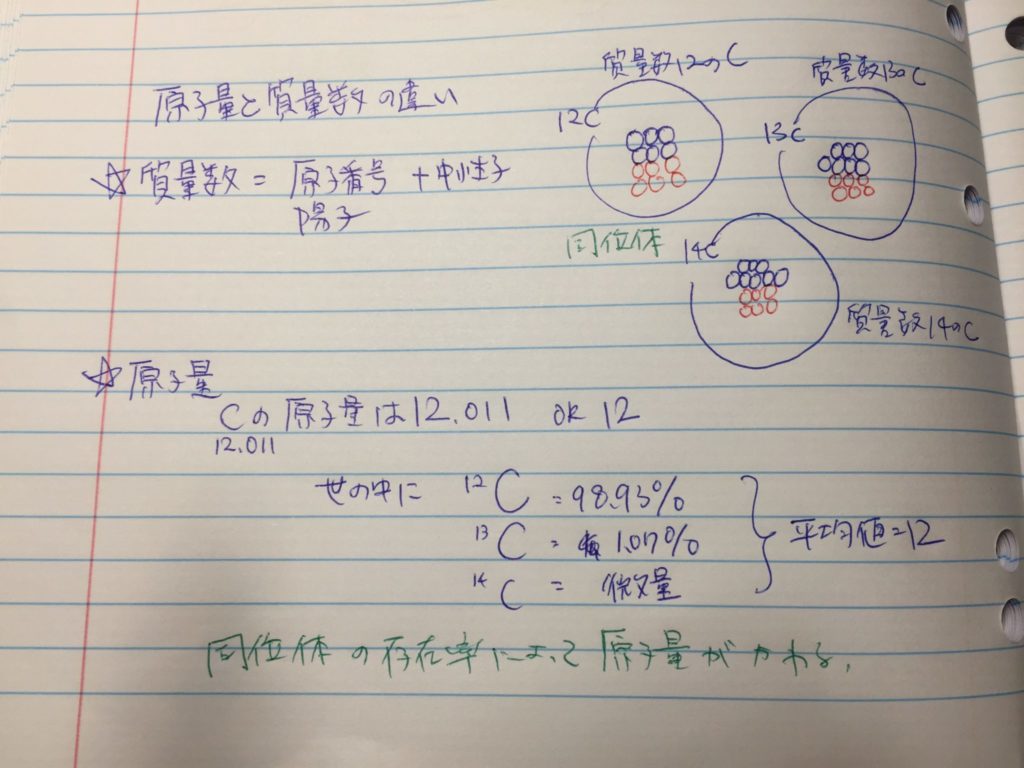
質量数は、ある元素の原子の陽子と中性子の数を足した数。陽子の数は一定でも中性子の数が異なることで質量が変わる。(質量が異なる原子を同位体と呼ぶ。)
原子量は、元素の同位体の質量の数と存在比を掛けて、それぞれ足して平均値を出した量。なので、同位体の存在率の比率によって原子量が変わってくる。
炭素はほとんどが質量数12の炭素がしめているので、原子量は限りなく12に近い12.009となる。
学習・作業時間
学習時間 8h
明細書探し作業 30m
テキスト整理+Xシリーズに関する動画の視聴 1h
ブログ 40m
明日の課題
岡野の化学
明細書読み:逆浸透膜関係