動画視聴
TC0091_岡野の化学(91).mp4
今朝もばっちり目が覚めて、軽く体操をして岡野視聴開始。
そのまま、ノリノリ化学に突入したいところでしたが、
本日は肉体労働のパート。
思いのほか忙しく帰宅が遅くなったものの、夕食後、今朝みた動画からノートまとめ。
お題は電気陰性度。
今までも有機化学で電気陰性度の話はちらほらでてきて、
周期表の右上の方の元素が電気陰性度が強いんだよね?程度の理解しかなかったのですが、もう一つ切り込むことができました。
電気陰性度とは
電気陰性度(でんきいんせいど、英: electronegativity)は、分子内の原子が電子を引き寄せる強さの相対的な尺度であり、ギリシャ文字のχで表される。 -Wikipedia
Wikipedia様のこの文面前にも読みました。その時は分かったつもりでも理解でてきていませんでした。
今日、なるほど。と思ったのは講座動画で紹介されていた以下の図。
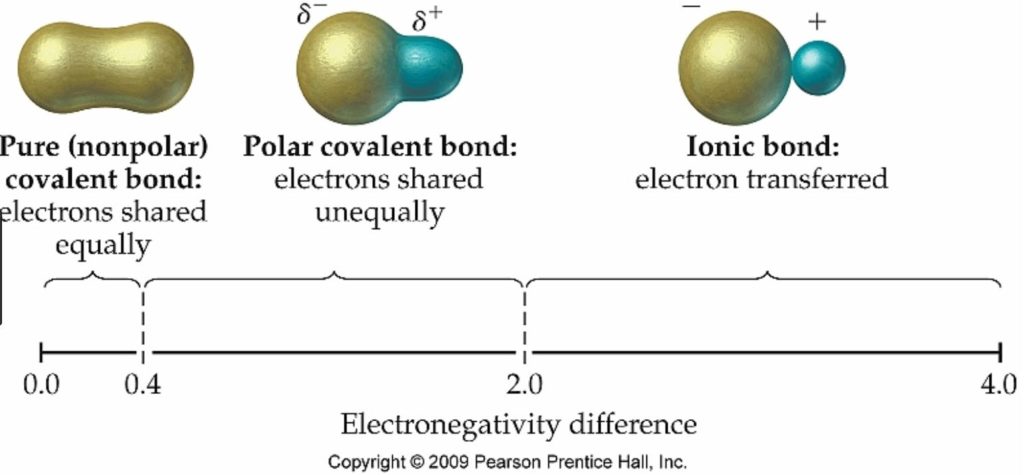
参考 https://goo.gl/images/pYj39M
左から共有結合 ⇒ 極性共有結合 ⇒ イオン結合の順で電気陰性度は大きくなっていく(表では0⇒4.0の数値で表されていて数字が多くなるほど電気陰性度が強い。)
電子に着目すると、共有結合は電子が等しく共有 ⇒ 極性共有結合は電子が等しくなく共有 ⇒ イオン結合は電子が移る。
私の今のメタで水素が変化していくという観点(実際の結合とは関係ありません。)で表現させていただきますと、、、
ノーマル原子(例:H) ⇒ 他の原子に電子が引っ張られて電荷が偏った原子(例:Hδ+) ⇒ 偏りだけじゃ足りなくて電子をそのまま相手にあげちゃったイオン(例:H+)
引っ張られる側からみて:ノーマル(気持ちの揺れ幅:0.0) ⇒ ちょっかい出されてちょっと気持ちが向いてきちゃった(切後の揺れ幅:0.4~2.0) ⇒ 押しに負けてすべてを預けちゃった(気持ちの揺れ幅:2.0~4.0)
という、ここまでがコレ!という明確な状態ではなくあくまでも相対的だってこと。
無極性と極性
無極性(nonpolar)、極性(polar)の違いも電気陰性度に関りがあり、
H:H、Cl:Clなどの共有結合は同じ原子同士イーブンなので、極性が偏らず無極性。
極性分子の代表的な水H2Oは、構造も関係するが、電気陰性度が強いOがHを二つ引っ張るこむので、Hの+電荷がOに引き込まれて極性となる。Oδ+、Hδ- となる。(イオン結合みたいに電子をあげるところまではいかない、強いものが弱いものを引っ張ってる状態。)
ただし、CO2は、電気陰性度3.5のO : 電気陰性度2.5のC:電気陰性度3.5のO とい結合でCとOの電気陰性度に差があるので極性があるかと思うが、CO2の結合の構造が直線であることと、H2Oのように、真ん中のOが二つを引っ張るのとは対照的に、Cが両側からOに引っ張られている構造なので、無極性となる。
水素結合
極性分子(δ+、δ-)として共有結合した水素(Hδー)が他の分子のδ+となっている、窒素(N)、フッ素(F)、酸素(O)などと結合する。
ただし、H(δ+):Cl(δー)の結合は極性分子だけど、水素結合しない。
理由は、原子のサイズが関係する。
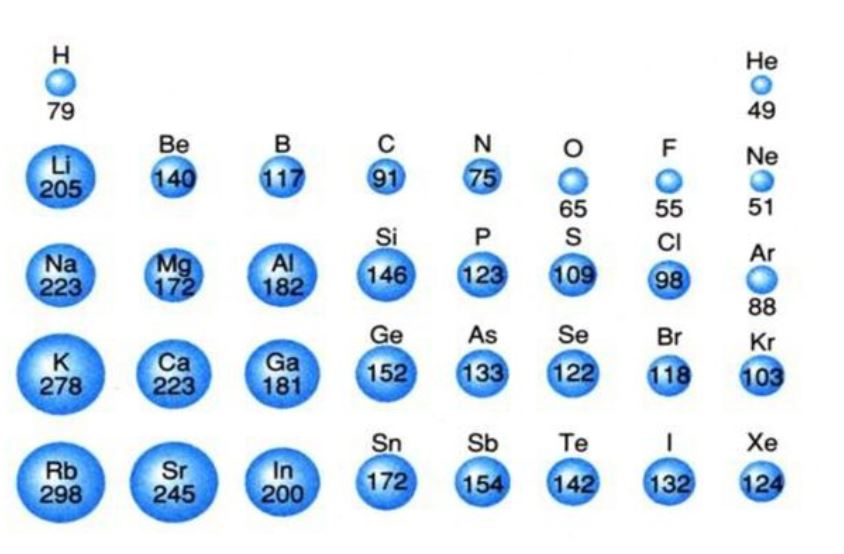
参考 https://goo.gl/images/CREuCy
Cl以外の極性の強い原子、N、O、Fに比べてClはサイズが大きい。
サイズが大きい=表面積が大きい。
表面積が大きいと引っ張る力が分散されて、N、O、Fに比べたら引っ張る力も分散されて弱くなる。
ので、水素結合できるほどは極性が強くない。(相対的に)
腑に落ちたポイント
本日の腑に置いたポイントは、相対的であるということ。
〇は〇、●は●って明確なのではなく、●と比べたら〇は◆◆。〇と比べたら◎は▲▲といったところ。
また、前述したこの表みたいに状態が違うものを比較しているものを見る、書くということで理解がしやすい。

ちなみに、δ+、δ₋も理解している気でいままでいましたが、引っ張られてるものと引っ張るものがいて、偏ってる状態。
でも、電子をまるまるあげたりもらったりするほどではないよ。というところで腑に落とすことができました。
うーん、まだまだ稚拙な表現しかできないけど、今の理解はこの程度です。
学習時間3h
ブログ1h