講座動画視聴
TC0126_岡野の化学(126)
TC0127_岡野の化学(127)
TC0128_岡野の化学(128)
TC0129_岡野の化学(129)
TC0130_岡野の化学(130)
TC0131_岡野の化学(131)
TC0132_岡野の化学(132)
TC0133_岡野の化学(133)
pHとpKaの違い
酸と塩基の学習。以前、有機化学の学習中でも何度もでてきた酸と塩基。
以前よりは酸と塩基の定義も混乱することなくスムーズに理解できるようになりつつあるものの、本日は中和滴定、酸、塩基のキーワードで特許の検索をしたところ、
pKa:酸解離定数、という概念を目にし、pH(水素イオン濃度)との違いを把握するために時間がかかった。
「ブルース有機化学」にちょうど「pKaとpH」という章があり、違いが明確に記載されていた。
pH(potential of hydrogen)は溶液の酸性度。
溶液中の水素イオンの濃度のこと。
物質によってpHで表され、濃度によって値が変わってくる。
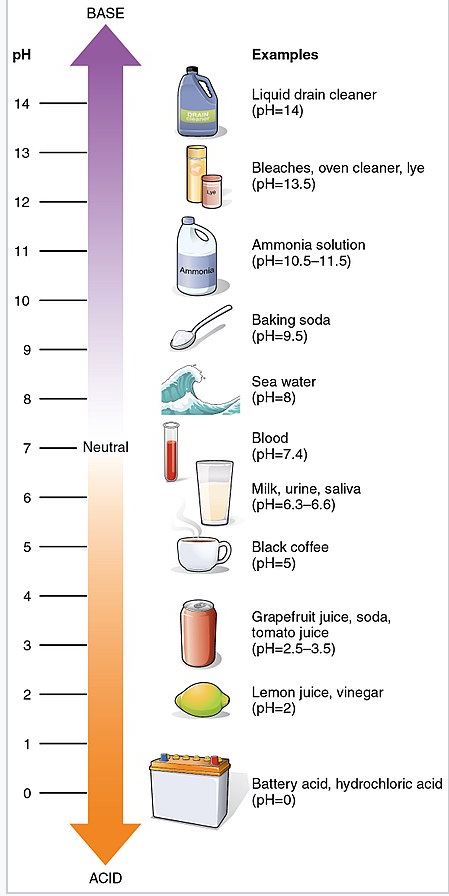
参考 https://ja.wikipedia.org/wiki/%E6%B0%B4%E7%B4%A0%E3%82%A4%E3%82%AA%E3%83%B3%E6%8C%87%E6%95%B0
対するpKaは、化合物固有の値、その化合物がプロトンをどの程度放出するかを示す尺度。
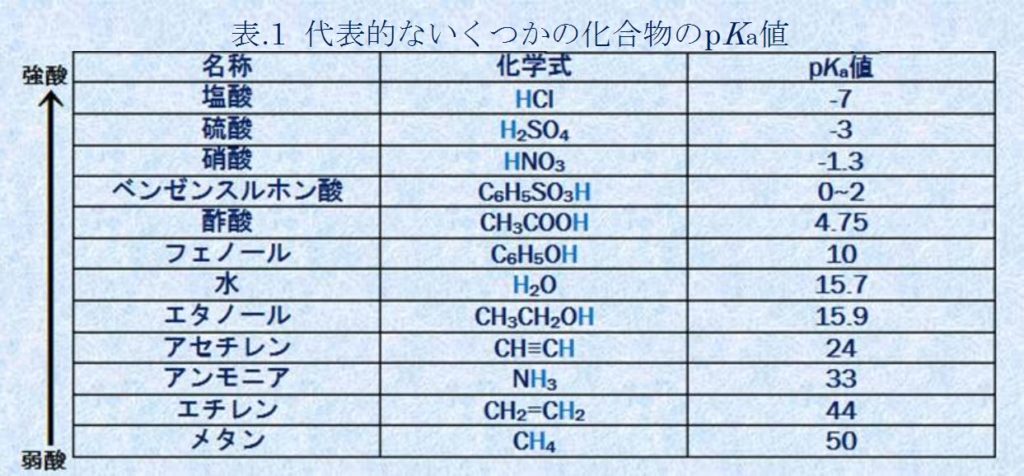
参考 http://sekatsu-kagaku.sub.jp/acid-dissociation-constant.htm
大枠の違いが理解できたものの、中身を腑に落とすところまではできていないので、明日は電離度、電離平衡など他の概念と併せてノート作りをする。
明日の課題
酸と塩基、電離平衡のまとめ
岡野の化学134、135
物理復習:放物運動